癌症治疗须知:什么是抗体偶联药物(ADCs)?
发布日期:2021-06-25抗体药物偶联物(ADCs)是一类靶向性强的生物制药,通过一个化学链接将单克隆抗体与强效抗癌药物结合起来,这些单克隆抗体能特异性靶向肿瘤细胞的表面抗原。
目前有八种ADCs药物获批上市,ADCs已经成为肿瘤学和血液学中一类强大的治疗药物。
概述
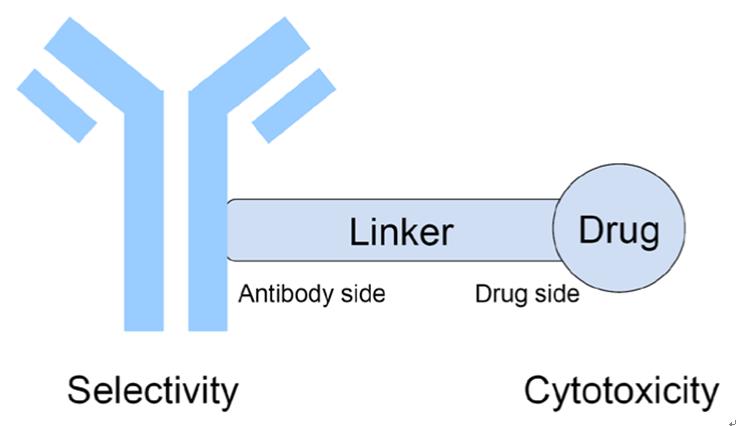
ADCs是一种将单克隆抗体与细胞杀伤制剂相连在一起所产生的强化抗体(mAbs),目的是要利用单克隆抗体的靶向性。理想的ADCs应该具备以下要素:
* 单克隆抗体(mAb)对肿瘤相关抗原具有高度靶向选择性,且对正常(健康)细胞低表达或不表达;
* 有效的细胞毒性药物(通常是具有高全身毒性的小分子药物),在被肿瘤细胞吞噬并释放后可导致靶细胞死亡;
* 链接在血液循环系统中可稳定存在,而在靶细胞内可以释放细胞毒性剂。
* 单克隆抗体与小分子药物共价连接,对癌细胞具有特定靶向性,降低了全身毒性
* 增加单克隆抗体(mAbs)的细胞杀伤力,并且
* 具有更高的肿瘤细胞选择性。因此,也能提高药物耐受性。
* 与标准化疗药物或生物制剂相比,全身毒性暴露量有限。
ADCs的作用机制是:(1)抗体与肿瘤的选择性结合,(2)内化,(3)溶酶体降解,并释放细胞毒性载荷,从而导致细胞毒性死亡。
01:一种创新的治疗应用
ADCs是一种新型高效的生物技术药物,它通过一个化学链接将具有生物活性的药物或细胞毒性化合物连接到抗体上。作为一种靶向类药物,它结合了抗体独特、高度敏感的靶向能力,能够敏感区分健康组织和癌症组织,并具有细胞毒素类药物的细胞杀伤活性。
截至目前,已有8种ADCs获批上市,近100种ADCs正处于临床前和临床试验阶段。
单克隆抗体具有独特的肿瘤特异性和抗肿瘤活性,但细胞毒性不够强,小分子药物具有良好的细胞杀伤活性,但毒性太强,不能单独使用。抗体偶联药物有效地将这两者结合,是一种创新的治疗应用。
由于ADCs能够直接将高细胞毒性的有效载荷传递给肿瘤细胞,因此可以实现对靶癌细胞的高致死率,同时不损害健康细胞。
科学家通过将单克隆抗体与细胞毒剂连接在一起,实现了对两者特征上的优化。ADCs由单克隆抗体、稳定链接和细胞毒剂三大主要部分构成,对多种癌症具有靶向性。ADCs将细胞毒(抗癌)药物连接(使用二硫化物或非裂解硫醚链接进行化学连接)至能够识别特定肿瘤相关抗原的单克隆抗体上,实现药物联合的高特异性。
简单来说,ADCs会将“去活化”的细胞毒素递送至特定的癌细胞。一旦进入癌细胞内,也就是完成“内化”过程之后,细胞毒素就会被释放出来,并完全恢复其癌细胞毒杀活性,进而实现快速杀灭细胞的能力。
虽然ADCs的概念相对简单明了、容易理解,但要设计并合成一种功能完备且高效的抗体偶联药物是十分具有挑战性的,这通常要求制药企业配备专业化的开发团队。
02:ADCs的构成
通过将单克隆抗体的独特靶向性与细胞毒性药物的抗癌能力相结合,ADCs可以区分健康组织和病灶组织。ADCs的研发需要结合生物技术和化学领域的创新成果,形成一类新型的高效生物制药药物,因此可以说,这是一项专业而困难的技术。
ADCs的独特性在于,这些“武装“抗体可以选择性地将高效的细胞毒性抗癌药物直接输送至癌细胞,同时不影响健康组织。
03:获批上市的ADCs
目前获批的药物包括吉妥单抗(辉瑞旗下惠氏制药),本妥昔单抗(西雅图遗传学公司/千禧制药),曲妥珠单抗-美坦新偶联物(罗氏旗下基因泰克),奥英妥珠单抗(辉瑞旗下惠氏制药),Enfortumab vedotin(安斯泰来制药集团/西雅图遗传学公司),Fam-trastuzumab deruxtecan-nxki(阿斯利康公司和第一三共公司),Polatuzumab vedotin-piiq(罗氏),Trodelvy(Immunomedics)。另外,有80多种新型ADCs尚处于临床试验阶段。由于药物技术的改进和靶向性的增强,ADCs的临床应用也正在加速。
常规化疗能够杀灭快速生长的肿瘤细胞,但同时也会损害健康细胞,引发不良的副作用。相比之下,ADCs在提高治疗效果的同时能降低全身毒性。小分子药物通常具备这类优势。
04:链接技术
通过生物可降解、稳定的链接将单克隆抗体与肿瘤细胞结合,并区分肿瘤和正常组织,ADCs能给癌细胞递送高效的细胞毒性抗癌药物。
链接技术的进步在于提高单克隆抗体与细胞毒性抗癌药物结合,控制药物的药代动力学,并显著改善细胞毒性药物向癌细胞的传递。
05:作用机制
ADCs是一种三组分体系,强效细胞毒性抗癌剂通过可生物降解的链接连接到抗体上。抗体与癌细胞表面的特定标记物(抗原或受体)相结合。之后,ADCs全部被内化至肿瘤细胞中,在此过程中,链接降解并释放出活性药物。
细胞毒性药剂集中输送至肿瘤细胞中,从而达到ADC最好的抗肿瘤效果并尽量减少其与正常组织的接触。这种设计有望提高治疗指数。
ADCs的作用机制较为简单。静脉注入的ADC的一部分到达肿瘤并结合肿瘤细胞表面的靶抗原后,这一复合体将被细胞内化。内化后,到达内部的囊泡与其他囊泡融合,并进入内体-溶酶体通路。在溶酶体中,蛋白酶在温和的酸性环境里消化单克隆抗体,释放自由载荷,穿过溶酶体膜进入细胞质和/或细胞核,与靶分子结合,进而导致细胞死亡。
06:特异性和有效性
靶向ADCs与特异性肿瘤抗原的特异性结合,以及抗原-抗体复合物的内化,很大程度上决定了抗体靶向化疗的疗效。实现上述两点,才能确保偶联细胞毒剂在肿瘤细胞内的靶向传递。
细胞毒性药剂集中运输到肿瘤细胞,有助于实现最大的抗肿瘤效果。它还可以最大程度地减少正常组织对药物的暴露,从而改善治疗效果并减少对周围健康组织的损害。
07:抗体亲和力
单克隆抗体亲和力,即抗体与表位(抗原决定簇)以及抗体与选择抗原结合的强度,是ADCs的一个重要因素。高亲和力抗体可能产生更大的摄取,从而增加治疗优势。然而,尽管抗原阳性细胞“外层”的摄取可能更高,但在“大块肿瘤”的穿透和分布可能会减少。
08:细胞毒性药物
源于自然或化学合成的细胞毒素有数千种,但只有极少数适合作为ADC的成分使用。在早期的ADC研发中,研究人员使用了临床批准的化疗剂。一个原因是这些药剂容易获得,另外其毒性已经众所周知。
然而,相较于相应的非偶联药物,这些早期ADC对靶向肿瘤细胞的效力中等,毒性通常更低。
为了解决此问题,科学家开始研究作为化疗药物单用时毒性过高的合成药物。但是这些高效力毒素的数量相当有限,其毒性通常是传统抗癌药物的100到1000倍,并且性能稳定。其中有具备高效力和生物活性的抗微管剂、烷化剂和DNA小沟区结合剂,现在已与人源化mAb靶向剂联合使用。这些药物具备ng/kg水平的生物活性,成为了最有效的晚期癌症药物。
微管蛋白聚合抑制剂(如maytansinoids、dolastatins、auristatin类似物和cryptophycin)的细胞毒性与它们通过结合微管蛋白从而抑制细胞分裂的能力有关,这能让细胞停滞在G2/M期,进而导致细胞凋亡。这些制剂包括duocarmycin derivative,如CC-1065类似物,杜卡霉素(一种DNA烷基化剂),Enediyne抗生素,包括,esperamicin和calicheamicin(能够催化DNA双链断裂),Pyrrolobenzodiazepine(DNA小沟区结合剂)。其中,Pyrrolobenzodiazepine在细胞培养基中显示,浓度为20 pmol/L时对体外培养人肿瘤细胞系具有细胞毒性作用。





